|
درباره وبلاگ به وبلاگ من خوش آمدید آخرین مطالب پيوندها
نويسندگان علوم تجربی nanopa پلوتونیوم یک عنصر شیمیایی رادیواکتیو و فلزی است که نماد آن Pu و عدد اتمی آن ۹۴ میباشد. وزن اتمی این عنصر ۲۴۴٫۰۶ بوده و چگالی آن ۱۹٫۸۰۰ kg/m۳ میباشد. پلوتونیوم در سال ۱۹۴۰ توسط دکتر GlennT.Seaborg، Edwin McMillan, Kennedy و Wahl از طریق بمباران دوترونی اورانیوم در سیکلوترون (شتابدهنده ذرات مدور) Berkeley Radiation Laboratory دانشگاه کالیفرنیا برکلی کشف شد. اما این کشف تا مدتها سری باقی ماند. این عنصر با توجه به کشف سیاره پلوتو که درست بعد از نپتون کشف شد، پلوتونیوم نام گرفت.(پلوتون در منظومه شمسی بعد از نپتون قرار دارد). كاربرد ها
پلوتونیوم یکی از مواد مهم شکافت هستهای در سلاحهای هستهای پیشرفته است. باید احتیاط لازم جهت جلوگیری از جمع شدن مقداری از پلوتونیوم که به جرم بحرانی نزدیک میشود به عمل آورد، چرا که این مقدار از پلوتونیوم خودبه خود واکنشهای شکافت هسته ای تولید میکند. بدون توجه به محدود نشدن پلوتونیوم توسط فشار خارجی که برای یک سلاح هستهای لازم است، پلوتونیوم میتواند خودش را گرم کرده و هر چیزی را که، پیرامون آن را محدود میکند بشکند. جلوگیری شود. شکل ظاهری پلوتونیوم هم در این امر موثر است، بنابر این، باید از ایجاد اشکال فشرده مانند کره، پرهیز کرد. همچنین پلوتونیوم مخصوصا نوع بسیار خالص آن، آتش زا بوده و به صورت شیمیایی با اکسیژن و آب واکنش میدهد که میتواند باعث انباشتگی هیدرید پلوتونیوم و یک ترکیب Pyrophoric شود، که مادهای است که در دمای اطاق در هوا میسوزد. حجم پلوتونیوم به هنگام ترکیب شدن با اکسیژن بسیار افزایش میابد و میتواند ظرف خود را بشکند بنابر این احتیاطهای لازم برای حمل پلوتونیوم در هر شکل آن، باید انجام شود، عموماً یک اتمسفر خشک و خنثی نیاز میباشد[۱]. علاوه بر اینها، خطرات رادیو اکتیوی نیز وجود دارد. خاک اکسید منیزیم موثرترین ماده برای فرو نشاندن آتش پلوتونیوم میباشد. آن ماده مشتعل را مانند یک کاهنده دما(Hit Sink)سرد میکند و در عین حال از رسیدن اکسیژن به آن جلوگیری میکند. آب نیز در این مورد موثر است. در سال ۱۹۶۲ در Rocky Flats Plant در نزدیکی Boulder, Colorado یک آتش سوزی بزرگ پلوتونیومی رخ داد. پلوتونیوم همچنین در ساخت جنگافزار هسته ای و ساخت زهرهای (نه الزاما مهلک) کاربرد دارد. تودههای انباشته شده پلوتونیوم توسط اتحاد جماهیر شوروی قدیم و ایالات متحده آمریکا به وجود میآمد.از پایان جنگ سرد تمرکز بر نگرانی ازگسترش تکنولوژی هستهای بوجود آمد. در سال ۲۰۰۲ دپارتمان انرژی ایالات متحده ۳۴ تن از مواد پلوتونیوم را که برای ساخت سلاحهای هستهای استفاده میشد را از دپارتمان دفاع ایالات متحده گرفت و از اوایل سال ۲۰۰۳ تصمیم گرفت برای خلاصی از این اورانیومها، به تبدیل چندین نیروگاه هستهای در آمریکا، از سوخت اورانیوم غنی شده به سوخت MOX اقدام کند. خطرات گاهی اوقات از پلوتونیوم با عنوان سمیترین ماده شناخته شده بر انسان نام برده میشود و این در حالی است که یک توافق کلی در میان کارشناسان مبنی بر نادرست بودن این مطلب وجود دارد. تا سال ۲۰۰۳ تنها یک مورد مرگ انسان به علت مجاورت و ارتباط با پلوتونیوم وجود داشتهاست. رادیومی که به صورت طبیعی به وجود میآید حدودا ۲۰۰ برابر سمی تر از پلوتونیوم است و برخی از Toxinهای آلی مانند سم بوتولین میلیاردها برابر سمی تر از پلوتونیوم میباشند. به هر حال، حوادث بحرانی نیز وجود داشته.حمل بی ملاحظه ۶٫۲ kg پلوتونیوم کروی در Los Alamos در ۲۱ آگست ۱۹۴۵، باعث انتشار دوز مرگبار تشعشع گردید. Harry Daghlian دوزی در حدود ۵۱۰ rem دریافت کرد، او ۴ هفته بعد درگذشت.مرگ دیگری در سال ۱۹۵۸ در واحد غنی سازی اورانیوم Los Alamos روی داد. پلوتونیوم در یک مخزن مخلوط کن جمع شده بود. یک بار جدید هم به آن منتقل شد و در نتیجه ۸ کیلوگرم پلوتونیوم در مرکز مخزن جمع شد. یک کارگر در معرض تشعشع قرار گرفت و در کمتر از دو روز در گذشت. حالتهای سمی پلوتونیوم از نظر شیمیایی و پرتوشناسی، باید از خطرات پلوتونیوم متمایز شود. بسیاری از جنبشهای ضد هستهای و در ادامه جنبشهای سیاست سبز از پلوتونیوم به عنوان خطرناکترین ماده شناخته شده برای بشریت یاد کرده و تنها دلیلشان نقش مهلک آن در تولید سلاحهای هستهای میباشد. احتمالاً اخلاط این دو دیدگاه است که باعث گزافه گوییهای احساسی در خصوص سمی بودن پولوتونیوم میشود. در سال ۱۹۸۹ نوشتهای از Bernard L. Cohen اینگونه بیان میکند که «خطرات پلوتونیوم خیلی آشکار تر و راحت تر از خطرات ناشی از مواد افزودنی به غذاها و همچنین حشره کشها فهمیده میشوند و در مقایسته تنها یک مرگ در هر ۳۰۰ سال میتواند کم مایه بودن این نظر را اثبات کند. و علارغم حقایقی که ما در اینجا ذکر کردیم و حقایق شناخته شده بر جامعه علمی افسانه سمی بودن پلوتونیوم همچنان ادامه دارد.» بنابراین هیچ گونه شک و تریدی وجود ندارد که پلوتونیوم در صورت استفاده نادرست میتواند بسیار خطرناک باشد. پرتوی آلفا که پلوتونیوم از خود ساطع میکند نمیتواند به پوست نفوذ کند، اما میتواند به اندامهای داخلی در صورت تنفس و یا خوردن پلوتونیوم آسیب برساند. ذرات بسیار کوچک پلوتونیم در صورت تنفس و رسیدن به ریهها میتوانت باعث به وجود آمدن سرطان ریه شود. مواد دیگر از جمله ricin، سم botulinum و سم tetanus در دوزهائی کمتر از یک میلی گرم، میتوانند کشنده باشند، بنابراین پلوتونیوم از این نظر غیر عادی نیست.مقادیر قابل توجه بیشتر آن، در صورت بلع یا تنفس، میتواند باعث به وجود آمدن مسمومیت رادیویی حاد و مرگ شخص شود با این وجود تا کنون هیچ مورد مرگ به علت خوردن و یا تنفس پلوتونیوم دیده نشده و بسیاری از مردم مقدار قابل توجهی پلوتونیوم در بدن خود دارند. دو شنبه 1 آبان 1391برچسب:, :: 23:3 :: نويسنده : p-a
اورانیم یا یورانیم[۳] یکی از عنصرهایشیمیایی است که عدد اتمی آن ۹۲ و نشانه آن U است و در جدول تناوبی جزو آکتنیدها قرار میگیرد. ایزوتوپ ۲۳۵U اورانیم در نیروگاههای انرژی هستهای به عنوان سوخت و در سلاحهایاتمی به عنوان ماده منفجره استفاده میشود. اورانیم به طور طبیعی فلزی است سخت، سنگین، نقرهای رنگ و پرتوزا. این فلز کمی نرم تر از فولاد بوده و تقریبآ قابل انعطاف است. اورانیم یکی از چگالترین فلزات پرتوزا است که در طبیعت یافت میشود. چگالی آن ۶۵٪ بیشتر از سرب و کمی کمتر از طلا است. سالها از اورانیم به عنوان رنگ دهنده لعاب سفال یا برای تهیه رنگهای اولیه در عکاسی استفاده میشد و خاصیت پرتوزایی (رادیواکتیو) آن تا سال ۱۸۶۶ میلادی ناشناخته ماند و قابلیت آن برای استفاده به عنوان منبع انرژی تا اواسط قرن بیستم میلادی مخفی بود. فراوانی این عنصر از نظر فراوانی در میان عناصر طبیعی پوسته زمین در رده ۴۸ قراردارد. اورانیم در طبیعت بصورت اکسید و یا نمکهای مخلوط در مواد معدنی (مانند اورانیت یا کارونیت) یافت میشود. این نوع مواد اغلب از فوران آتشفشانها بوجود میآیند و نسبت وجود آنها در زمین برابر دو در میلیون نسبت به سایر سنگها و مواد کانی است. اورانیم طبیعی شامل ۹۹/۳٪ از ایزوتوپ ۲۳۸U و ۰/۷٪ ۲۳۵U است. این فلز در بسیاری از قسمتهای دنیا در صخرهها، خاک و حتی اعماق دریا و اقیانوسها وجود دارد. میزان وجود و پراکندگی آن از طلا، نقره یا جیوه بسیار بیشتر است. در ایران بزرگترین منبع اورانیم مربوط به ساغند اردکان می باشد. ویژگیهای اورانیم اورانیم یکی از سنگینترین (به بیان دقیقتر چگالترین) 18,97 g/cm³ عنصری است که در طبیعت یافت میشود (هیدروژن سبکترین عنصر طبیعت است Platin 21,45 g/cm³ .) اورانیم خالص حدود ۱۸/۷ بار از آب چگالتر است و همانند بسیاری از دیگر مواد پرتوزا در طبیعت بصورت ایزوتوپ یافت میشود. اورانیم شانزده ایزوتوپ دارد. حدود ۹۹/۳ درصد از اورانیمی که در طبیعت یافت میشود ایزوتوپ ۲۳۸ (U-۲۳۸) است و حدود ۰/۷ درصد ایزوتوپ ۲۳۵ (U-۲۳۵). دیگر ایزوتوپهای اورانیم بسیار نادر هستند. در این میان ایزوتوپ ۲۳۵ برای بدست آوردن انرژی از نوع ۲۳۸ آن بسیار مهمتر است چرا که U-۲۳۵ (با فراوانی تنها ۰/۷ درصد) آمادگی آن را دارد که در شرایط خاص شکافته شود و مقادیر زیادی انرژی آزاد کند. به این ایزوتوپ «اورانیم شکافتنی» (Fissil Uranium) هم گفته میشود و برای شکافت هستهای استفاده میشود. اورانیم نیز همانند دیگر مواد پرتوزا دچار تباهی میشود. مواد رادیو اکتیو دارای این خاصیت هستند که از خود بطور دائم ذرات آلفا و بتا و یا اشعه گاما منتشر میکنند. U-۲۳۸ باسرعت بسیار کمی تباه میشود و نیمه عمر آن در حدود ۴، ۵۰۰ میلون سال (تقریبآ برابر عمر زمین) است. این موضوع به این معنی است که با تباه شدن اورانیم با همین سرعت کم انرژی برابر ۰/۱ وات برای هر یک تن اورانیم تولید میشود و این برای گرم نگاه داشتن هسته زمین کافی است. شکافت هستهای اورانیم U-۲۳۵ قابلیت شکاف هستهای دارد. این نوع از اتم اورانیم دارای ۹۲ پروتون و ۱۴۳ نوترون است (بنابراین جمعآ ۲۳۵ ذره در هسته خود دارد و به همین دلیل U-۲۳۵ نامیده میشود)، کافی است یک نوترون دریافت کند تا بتواند به دو اتم دیگر تبدیل شود. این عمل با بمباران نوترونی هسته انجام میگیرد، در این حالت یک اتم U-۲۳۵ به دو اتم دیگر تقسیم میشود و دو، سه و یا بیشتر نوترون آزاد میشود. نوترونهای آزاد شده خود با اتمهای دیگر U-۲۳۵ ترکیب میشوند و آنها را تقسیم کرده و به همین منوال یک واکنش زنجیرهای از تقسیم اتمهای U-۲۳۵ تشکیل میشود. اتم U-۲۳۵ با دریافت یک نوترون به اورانیم ۲۳۶ تبدیل میشود که ثبات و پایداری نداشته و تمایل دارد به دو اتم با ثبات تقسیم شود. انجام عمل تقسیم باعث آزاد شدن انرژی میشود بگونهای که جمع انرژی حاصل از تقسیم زنجیره اتمهای U-۲۳۵ بسیار قابل توجه میشود. نمونهای از این واکنشها به اینصورت است: U-۲۳۵ + n U-۲۳۵ + n که در آن: electron Volt = ۱٫۶۰۲ x ۱۰-۱۹ joules (یک ژول انرژی برابر توان یک وات برای مصرف در یک ثانیهاست.) مجموع این عملیات ممکن است در محلی بنام رآکتور هستهای انجام گیرد. رآکتور هستهای میتواند از انرژی آزاد شده برای گرم کردن آب استفاده کند تا در نهایت از آن برای راه اندازی توربینهای بخار و تولید برق استفاده شود. دو شنبه 1 آبان 1391برچسب:, :: 22:59 :: نويسنده : p-a
آرگون با علامت اختصاری Ar در جدول عناصر دارای شماره اتمی ۱۸ است. گاز آرگون در اتمسفر زمین تا حدود ٪۱ موجود است. آرگون برای به وجود آوردن نورهای زنده استفاده میشود. همچنین دارای مصارفی در صنایع جوشکاری، اسپکتروسکوپی و تولید تیتانیوم نیز میباشد. خواص آرگون عنصری است غیر فلزی با نشانه اختصاری A یا Ar با عدد اتمی ۱۸، جرم اتمی ۳۹٫۹۸ که در گروه گازهای نجیب و در دوره سوم جدول تناوبی جای دارد. مشخصات
گازی است بی رنگ بی بو ٬بیمزه٬تک اتمی ٬ترکیب شیمیایی آن تا کنون شناخته نشدهاست نقطه انجماد -۱۸۹٫۳ نقطه جوش ۱۸۵٫۸ ٬چگالی ویژّ ۱٫۳۸(هوا=۱) در آب کمی حل میشود ٬اشتعال پذیر نی ست
كاربرد پرکردن حبابهای لامپها و پنجرههای دوجداره، تصفیه زیرکنیوم، شستن فلزهای مذاب تا گازهای حل شده را از آن جدا کند، در لولههای شمارشگر گایگر٬ لیزرها، کربن گیری از فولاد ضدزنگ و همچنین در نوع خاصی از جوشکاری به عنوان گاز محافظ قوس الکتریکی به کار میرود.
دو شنبه 1 آبان 1391برچسب:, :: 22:52 :: نويسنده : p-a
( هيدروژن ) هیدروژن یا آبزا، با نماد شیمیایی H نام یک عنصر شیمیایی در جدول تناوبی با عدد اتمی ۱ است. وزن اتمی این عنصر ۱٫۰۰۷۹۴ u است. هیدروژن سبکترین عنصر در جهان است و بیش از دیگر عنصرها میتوان آن را به صورت آزاد در طبیعت پیدا کرد. میتوان گفت نزدیک به ۷۵% از جرم جهان از هیدروژن ساخته شدهاست. برخی جرمهای آسمانی مانند کوتولهٔ سفید و یا ستارههای نوترونی از حالت پلاسمای هیدروژن ساخته شدهاند. ولی در طبیعت روی زمین به سختی میتوان تک اتم هیدروژن را پیدا کرد. ایزوتوپی از هیدروژن که بیشتر دیده میشود، پروتیوم نام دارد (بیشتر از نماد آن ۱H یاد میشود تا نام آن) این ایزوتوپ، یک پروتون دارد و نوترون ندارد و در ترکیبهای یونی میتواند بار منفی (آنیون هیدرید با نماد -H) به خود بگیرد. همچنین بار مثبت آن نیز به صورت +H یافت میشود که در این صورت تنها از یک پروتون ساده ساخته شدهاست. البته در حقیقت بدست آوردن کاتیون هیدروژن در ترکیبهای پیچیده تری ممکن میشود. عنصر هیدروژن با بیشتر عنصرها میتواند ترکیب شود و میتوان آن را در آب، تمامی ترکیبهای آلی و موجودات زنده پیدا کرد. این عنصر در واکنشهای اسید و قلیایی در بسیاری واکنشها با داد و ستد پروتون میان مادهٔ حل شدنی و حلال نقش مهمی از خود نشان میدهد. هیدروژن به عنوان ساده ترین عنصر شناخته شده در دانش نظری بسیار کمک کار بودهاست، برای نمونه از آن در حل معادلهٔ شرودینگر و یا در مطالعهٔ انرژی و پیوند و در نهایت پیشرفت دانش مکانیک کوانتوم نقش کلیدی داشتهاست. گاز هیدروژن (با نماد H۲) نخستین بار در سدهٔ ۱۶ میلادی به صورت آزمایشگاهی از واکنش اسیدهای قوی با فلزهایی مانند روی بدست آمد (۱۷۶۶ تا ۸۱). هنری کاوندیش نخستین کسی بود که دریافت گاز هیدروژن برای خود، یک مادهٔ جداگانهاست.[۶] و از سوختن آن آب پدید میآید. دلیل نامگذاری هیدروژن هم همین ویژگی آن است به معنی آبساز در زبان یونانی. در شرایط استاندارد دما و فشار هیدروژن عنصری است بی رنگ، بی بو، بی مزه، نافلز، غیرسمّی یک ظرفیتی، گازی دو اتمی، بسیار آتشگیر و با فرمول شیمیایی H۲. در صنعت برای تولید هیدروژن از گاز طبیعی بهره میبرند و کمتر به الکترولیز آب روی میآورند.[۷] بیشتر هیدروژن تولیدی در نزدیکی محل تولید، در فرایند سوخت سنگوارهای (مانند کراکینگ) و تولید آمونیاک برای ساخت کود شیمیایی، مورد بهره برداری قرار میگیرد. امروزه دانشمندان در تلاش اند تا جلبکهای سبز را در تولید هیدروژن بکار ببندند. در دانش فلزشناسی، تردی هیدروژنی بسیاری فلزها مورد بررسی است تا با کمک آن در طراحی لولهها ومخزنها دگرگونیهایی پدید آورند . دو شنبه 1 آبان 1391برچسب:, :: 22:39 :: نويسنده : p-a
مشخصاتعدد اتمی: ۱۵ ۳۰٬۹۷۳۸ g.mol -۱: جرم اتمی حالت اکسایش : ± ۳, ۴, ۵ الکترونگاتیوی (بر اساس قرارداد :pauling): ۲٬۱ چگالی: ۱٬۸۲ g/ml at ۲۰°C نقطه ذوب: ۴۴٬۲ °C نقطهٔ جوش: ۲۸۰ °C شعاع اتمی: ۱٬۲۸ Å شعاع یونی: ۰٬۳۴ Å آرایش الکترونی: [Ne]۳s23p۳ انرژی نخستین یونش: ۱۰٬۱۱۸ eV انرژی دومین یونش: ۱۹٬۷۲۵ eV انرژی سومین یونش: ۲۹٬۱۴۱ eV کشف شده بوسیله : Hennig Brandt in ۱۶۶۹ فسفر یکی از اعضای نافلز چند ظرفیتی گروه نیتروژن میباشد. این عنصر به چندین شکل آلوتروپی در طبیعت یافت شدهاست و یکی از عناصر حیاتی برای زندگی ارگانیسمهای طبیعی (ترکیب موجودات زنده ) میباشد. چندین شکل فسفر وجود دارند که عبارت اند از:فسفر سفید، قرمز، سیاه؛ اگر چه رنگهای آنها تا حد زیادی به نظر میرسد تفاوت کمی با هم داشته باشد.فسفر سفید یکی از شکلهای فسفر است که به طور صنعتی تولید میشود که در تاریکی میتابد.و بی اختیار شعله ئر میشود در زمانی که در معرض هوا گیرد و سم مهلکی است.فسفر قرمز میتواند به خاطر تغییرات اندک در ساختار شیمیایی اش از رنگ نارنجی تا ارغوانی تغییر داشته باشد. شکل سوم، یعنی فسفر سیاه، که در زیر فشار بالا ساخته میشود شبیه به گرافیت بوده و مانند گرافیت توانایی هدایت اللکتریکی را دارد. به غیر از آب و غذا بدن انسان برای بقا نیاز ویتامینهای مشخص و مواد معدنی دارد. کلسیم و فسفر دو ماده معدنی مهم در بدن انسان هستند که با کمک همدیگر دندانها و استخوانها را میسازند. فسفر ۱ درصد کل وزن بدن را تشکیل میدهد، بنابراین اگر فردی ۱۵۰ پوند وزن داشته باشد یک و نیم پوند فسفر در بدن دارد. بیشتر فسفر بدن (در حدود ۸۵ درصد) در استخوانها و دندانها (جایی که با کلسیم برای ساختن استخوان قویتر و سخت تر ترکیب میشود) وجود دارد. بفیه فسفر در سلولها و بافتهای دیگر وجود دارد. در کلیهها، فسفر از نظیر تصفیه مهم است. فسفر همچنین به تعادل اسید-باز درخون کمک میکند. فسفر جریان انرژی در بدن را تنظیم کرده باعث کاهش درد عضلانی، بعد از یک کار سخت، میشود. بدن شما برای رشد، نگهداری و ترمیم همه بافتها و یاختههای بدن و همچنین برای جذب سایر ویتامینها و مواد معدنی از جمله ویتامین دی، کلسیم، ید، منیزیوم و روی نیاز به فسفر دارد. کاربردها در پزشکیدر حالت معمول نیاز به مصرف مکملهای فسفر وجود ندارد زیرا غذاهایی که ما میخوریم حاوی مقادیر کافی فسفر است، با اینحال در بعضی موارد برای مثال در شخصی که بیماری کلیوی دارد، پزشک مکملهای فسفر را تجویز میکند. بعضی از ورزشکاران قبل از شروع رقابت یا کارهای سنگین برای کاهش درد عضلانی و خستگی از مکملهای پتاسیم استفاده میکنند. مصرف فسفر و کلسیم با همدیگر میتواند باعث بهبود شکستگی استخوان و درمان کمبودهای ویتامین «دی» نظیراستئومالاسی (نرمی استخوان) و ریکتز شود. کاربردهای دیگرهم چنین از دیگر کاربردهای فسفر میتوان در اسید فسفریک غلیظ شده که در کودها برای کشاورزی و تولیدات کشاورزی کاربرد دارد.فسفاتها در شیشههای خاص، لامپ سدیم، تولید استیل و کاربردهای نظامی (بمبهای آتش زا ، smoke screeninng(پرده پوشش دود برای استتار یکانهای خودی) و غیره ) و در کاربردهای دیگر به عنوان سموم دفع آفات، خمیر دندان، مواد شوینده استفاده میشوند. فسفر در محیط زیستدر جهان طبیعت هرگز فسفر به شکل خالص دیده نشدهاست.اما تنها به شکل فسفات دیده شده که شامل اتم فسفر تشکیل پیوند داده با چهار اتم اکسیژن میباشد.این میتواند به شکل یون فسفات دارای بار منفی شده (PO۴۳-) که در مواد معدنی یا به عنوان organophosphates که مولکولهای ارگانیسمی چسبیده به یک، دو یا سه اتم اکسیژن هستند وجود دارد . مقدار فسفر ی که به طور طبیعی در غذا وجود دارد به طور قابل ملاحظهای تفاوت دارد اما میتواند به عنوان بیشترین مقدار در جگر ( mg/۱۰۰ g 370 ) یا کمترین مقدار در روغن گیاهیبباشد.غذاهای غنی از فسفر عبارت اند از :تن ماهی، ماهی قزا آلا، ماهی ساردین، کبد، بوقلمون، جوجه مرغ، تخم مرغ و پنیر (۲۰۰ g/۱۰۰ g).. کانیهای فسفات دار زیادی وجود دارند بیشترین آنها به شکل apatite هستند. Fluorapatite ببیشترین ذخیرهٔ استخراج شدهٔ معدنی فسفر را داراست.مناطق مهم و عمده استخراج معدنی این ماده در روسیه، مراکش، تانزانیا، توگو و Nauru (کشور ایسلند قرار گرفته در اقیانوس آرام (قلمرو قدیم استرالیا))هستند. تولید جهانی ۱۵۳ میلیون تن در سال است.نگرانیهایی در مورد اینکه تا چند سال دیگر این منابع فسفر باقی خواهند ماند، وجود دارد. در صورت کمبود این ماده میتواند مشکلات جدی در تولید غذای جهانی بوجد آید، به خاطر اینکه فسفر یکی از اجزائ مهم در کودها میباشد. در اقیانوسها، تجمع فسفر مخصوصا در سطح آنها خیلی کم است به این دلیل که آلومینیم فسفات و کلسیم فسفات بر روی سطح آب باقی میمانند.لی در موارد دیگر، در اقیانوسها، فسفات به سرعت کامل مصرف میشوندو به اعماق اقیانونوسها به عنوان organic debris میروند.مقادیر بیشتری از فسفاتهای میتوانند در رودخانهها و در یاچهها وجود داشته باشند که رشد بیش از اندازهٔ خزهها را موجب میشود. منابع غذاییگوشت قرمز و مرغ و بوقلمون حاوی مقادیر چشمگیری فسفر هستند. منابع دیگر شامل شیرخشک و محصولات شیر، پنیر سفت، ماهی کنسرو شده، آجیل، تخم مرغ و نوشابههای سبک است. اشکال دیگرفسفر غیرفلزی که یک ماده مومی زرد یا سفید است و در تماس با هوا قابل اشتعال است سمیت زیادی دارد و به عنوان دارو استفاده نیمشود .علاوه بر این پزشکان یک یا چند تا از فسفاتهای غیرآلی را که در زیر نامبرده شدهاست و سمی نیست، توصیه میکنند:
نحوه مصرفاگر زیر ۲۴ سال سن دارید و یا اینکه حامله یا شیرده هستید روزانه به ۱۲۰۰ میلی گرم فسفر نیاز دارید. برای افراد دیگر حد مجاز توصیه شده روزانه CRDA، ۸۰۰ میلی گرم است. چون اغلب نیاز بدن به فسفر از طریق رژیم غذایی تأمین میشود، جای هیچ گونه نگرانی در مورد مصرف مکملهای فسفر وجود ندارد. مسئله مهمتر این است که شما بر روی غذایی که میخورید دقت کنید تا تعادل مناسبی از کلسیم و فسفر در رژیم غذایی شما وجود داشته باشد. کم کردن گوشت و جایگزین کردن با نوشابههای سبک میتواند عدم تعادل بین کلسیم و فسفر را اصلاح کند. در همین زمان شما باید دقت کنید که کلسیم کافی مورد نیاز بدن را در رژیم غذایی جای دهید که اغلب کار مشکلی است. موارد احتیاطمصرف روزانه بیش از ۱ گرم فسفر میتواند باعث مسمومیت شود. مصرف زیاد فسفر میتواند منجر به اسهال و کلسیفیکاسیون (سخت شدن) اعضا و بافت نرم شده و توانایی جذب آهن، کلسیم، منیزیوم و روی را توسط بدن کاهش دهد. اگر شما ورزشکار هستید و از مکملهای حاوی فسفات استفاده میکنید، باید دقت کنید که از این مکملها فقط باید به صورت گاه گاهی استفاده کنید. متخصصین تغذیه یک میزان مساوی از کلسیم و فسفر را در رژیم غذایی توصیه میکنند، اما رژیم غذایی تیپیک آمریکایی حاوی کلسیم کم و فسفر زیاد (میزان فسفر ۲ تا ۴ برابر کلسیم) است. علت این امر بسیار سادهاست. گوشت قرمز و مرغ و بوقلمون حاوی فسفر به میزان ۱۰ تا ۲۰ برابر میزان کلسیم آن است، و آشامیدنیهای حاوی کربنات مانند "کولا" حدود ۵۰۰ میلی گرم فسفر در هر بار مصرف دارد. وقتی در سیستم شما فسفر بیشتر از کلسیم باشد، بدن کلسیم ذخیره شده داخل استخوانها را برداشت میکند تا عملکر طبیعی بدن انجام شود. این امر منجر به کاهش توده استخوانی و در نتیجه شکنندگی استخوان و یا مشکلات لثه و دندانها میشود. پایین بودن نسبت کلسیم به فسفر همچنین باعث افزایش خطر فشار خون بالا و سرطان کولورکتال میشود. یک تعادل مناسب بین کلسیم و فسفر رژیم غذایی میتواند باعث کاهش تنیدگی (استرس)، کاهش خطر پوکی استخوان و بهبود علایم آرتروز و دیگر مشکلاتی شود که مرتبط با توانایی بدن در استفاده از کلسیم است. تداخلهای احتمالیموارد زیر میتواند به کمبود فسفر کمک کند: تاثیرات فسفر بر روی سلامتیفسفرد در محیط زیست بیشتر به عنوان فسفات یافت شود.فسفاتها مواده مهمی در بدن انسانها میباشند، به خاطر اینکه آنها قسمتی از مواد تشکیل دهندهٔ DNAها بوده و در توزیع انرژی کمک کی کنند. فسفااتها هم چنین میتوانند به طور ریجی در گیاهان یافت شوند. انسان تامین فسفات طببیعی را را ه طور اساسی با اضافه کردن کودهای غنی شده با فسفات به خاک و با استفاده از detergents (مادهای که ناخالصیها را جدا میکند) محتوی فسفات تغییر دادهاند.فسفاتها هم چنین به تعدادی از foodstuff مانند پنیر، سوسیس، ژامبون اضافه میشوند. مقادیر زیاد فسفات میتواند باعث بوجود آمدن مشکلات سلامتی شود.مانند آسیب رساندن به کلیه و osteoporosis .کمبود فسفر نیز میتواند اتفاق بیفتد.که مصرف زیاد دارو میتواند عامل ایجاد آن باشد.کمبود شدید فسفات میتواند مشسکلات سلامتی ایجاد کند. فسفر به حالت خالص خود سفید رنگ است. تا آنجایی که امروزه میدانیم فسفر سفید خطرناکترین شکل فسفر است.زمانی که فسفر سفید در طبیعت قرار میگیرد میتواند خطر جدی برای سلامت ما تلقی گردد. فسفر سفید به شدت سمی است و در بیشتر موارد قرار گیری در معرض آن کشنده خواهد بود. علت مرگ مردمی که معمولاً در اثر قرار گیری در معرض فسفر سفید جان خود را از دست دادهاند، به خاطر بلعیدن به طور اتفاقی زهر موش بودهاست.قبل از اینکه مردم به خاطرقرار گیری در معرض فسفر سفید بمیرند، آنها اغلب استفراغ و درد شکم و خواب آلودگی را تجربه میکنند. فسفر سفید میتواند باعث سوختگی پوست شود.در عین سوزاننده بودن، فسفر سفید ممکن است موحب آسیب به کبد، قلب و کلیه شود فسفر سفیدزمانی فسفر سفید وارد محیط زیست میشود که صنایع از آن برای ساختن مواد شیمیایی دیگر استفاده کنند و ارتش از آن به عنوان مهمات استفاده کند.از طریق تخلیهٔ فاضلاب، فسفر سفید وارد آبهای سطحی نزدیک کارخانههایی میشود که از آن استفاده میکنند. فسفر سفید در هوا پراکنده نمیشود چون به سرعت با اکسیژن واکنش میدهد.وقتی فسفر سفید در هوا تمام میشود، معمولا با اکسیژن ناگهانی واکنش میدهد تا به کم خطرترین ذره تبدیل شود.اگر چه زمانی که ذرات فسفر در هوا باشند، انها ممکن است نقش پوشش محافظتی داشته باشند که از واکنشهای شیمیایی جلوگیری میکند. در آب، فسفر سفید به همان سرعت با مواد دیگر واکنش نمیدهد که موجب انباشته شدن در بدن ارگانیسمهای جانوران آبزی میشود.در خاک فسفر برای چند روز قبل از اینکه تبدیل به کم خطرترین ماده تبدیل گردد، باقی میماند.اما در اعماق خاک و در کف رودخانهها و دریاچهها فسفر ممکن است برای هزاران سال یا بیشتر و یا کمتر باقی بماند. فسفاتهافسفات تاثیرات زیادی بر روی ارگانیسمها دارند.این تاثیرات عمدتا نتیجهٔ بیرون دان مقادیر زیادی از فسفات به محیط زیست به خاطر استخراج معدن و زراعت است. در حین تصفیهٔ آب فسفاتها اغلب به طور کامل از آب جدا نمیشوند تا اینکه آنها میتوانند در یک مسافت طولانی منتشر شوند و در آبهای سطحی یافت شوند. به خاطر اضافه شدن دائمی فسفات بوسیلهٔ انسان و افزایش بیش از حد تجمع طبیعی، چرخهٔ فسفری شدیدا منقطع گردیدهاست. افزایش تجمع فسفر در آبهای سطحی رشد ارگانیسمهای وابسته به فسفر مانند خزهٔ دریایی و عدس آبی (duckweed )را بالا میبرد.این ارگانیسمها مقدار زیادی از اکسیژن را استفاده میکنند و از وارد شدن نور خورشید به داخل آب جلوگیری میکنند. این موجب میشود که آب برای دیگر ارگانیسمها ناعادلانه غیر قابل زندگی شود که این پدیده eutrophication. (انباشتگی خوراکه اب ) نامیده میشود. جمعه 28 مهر 1391برچسب:, :: 20:38 :: نويسنده : p-a
|

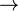 Ba-۱۴۱ + Kr-۹۲ + ۳n + ۱۷۰ Million electron Volts
Ba-۱۴۱ + Kr-۹۲ + ۳n + ۱۷۰ Million electron Volts